環化 問6
芳香族化合物の求電子置換反応に関する次の記述とその反応式の中で、その内容が誤っているものを一つ選べ。ただし、混酸は、濃硝酸と濃硫酸との混合物とする。
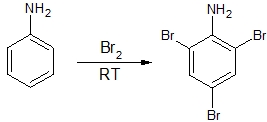
1.アニリンのうすい水溶液に、臭素水を室温で1滴ずつ臭素の色が消えなくなるまで加えると、2,4,6-トリブロモアニリンの沈殿が生成する。
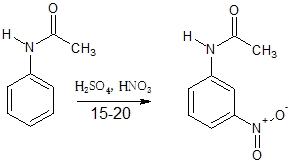
2.アセトアニリドを15℃~20℃において、混酸でニトロ化すると、モノニトロ化物として主に3-ニトロアセトアニリドが生成する。
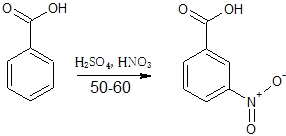
3.安息香酸を50℃~60℃において、混酸でニトロ化すると、モノニトロ化合物として主に3-ニトロ安息香酸が生成する。
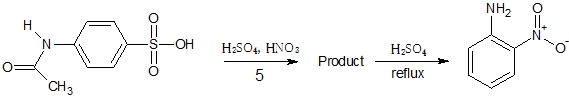
4.4-アセトアミドベンゼンスルホン酸を混酸でモノニトロ化し、その生成物を希硫酸とともに還流した後氷水に注ぐと、2-ニトロアニリンの沈殿が生成する。
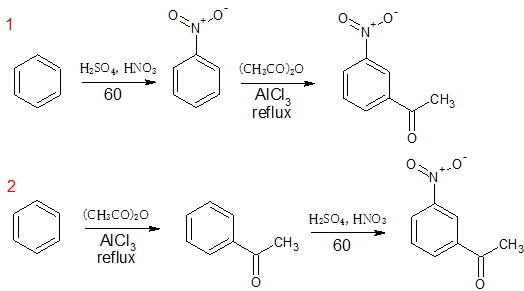
5.3-ニトロアセトフェノンを効率よく合成するには、ベンゼンをニトロ化後アセチル化する方法1よりも、アセチル化後ニトロ化する方法2のほうが良い。
この問題は、求電子置換反応の反応性を問う問題です。
この問題を解くカギは、
・芳香族に結合している置換基が電子供与性の場合、オルト、パラ配向性
・電子吸引性はメタ配向性
・求電子置換反応は、電子供与性が強いほど反応性が高い。
上記の点です。
【反応機構や反応性、配向性についての詳細はこちら】
・求電子置換反応の反応機構
・配向性と反応性
1は、ベンゼンに結合しているアミノ基が電子供与性のため、オルト、パラ配向性になります。したがって、正解
2は、アセトアニリドは電子供与性ですが、メタの位置にニトロ化されているため、誤り。
3は、安息香酸はカルボキシル基が電子吸引性の置換基のため、メタ配向性になる。正解。
4は、芳香族にアミド(電子供与性)とスルホン基(電子吸引性)が結合しているが、電子供与性の方が反応性が高いため、アミドよりオルト、パラ配向性になる。
生成物を希硫酸で還流するとアミドがアミノ基となる。正解。
5は、フリーデルクラフツアシル化反応です。
1のように先にニトロ化すると、アセチル基より電子吸引性が強いため、反応が遅くなる。
そこで、2のように先にアセチル化させて、ニトロ化させるほうが反応が早くなる。正解。
よって、2が誤りという問題です。


Your Message